Una de las líneas de investigación más novedosas y prometedoras de la biología actual está basada en el estudio de las células madre, sobre todo debido a que ofrecen una gran potencialidad dentro del ámbito de la biomedicina. En esta disciplina se han depositado numerosas expectativas con el fin de remediar importantes enfermedades masivas y nuestra esperanza de vida con mayor calidad en la salud. Ante tan excelente perspectiva, resulta natural preguntarnos ¿qué caracteriza a las células madre?, ¿por qué son importantes?
A continuación, trataremos de responder a cuestiones como las citadas, destacando el papel jugado por una gran científica en el desarrollo del ámbito biomédico.
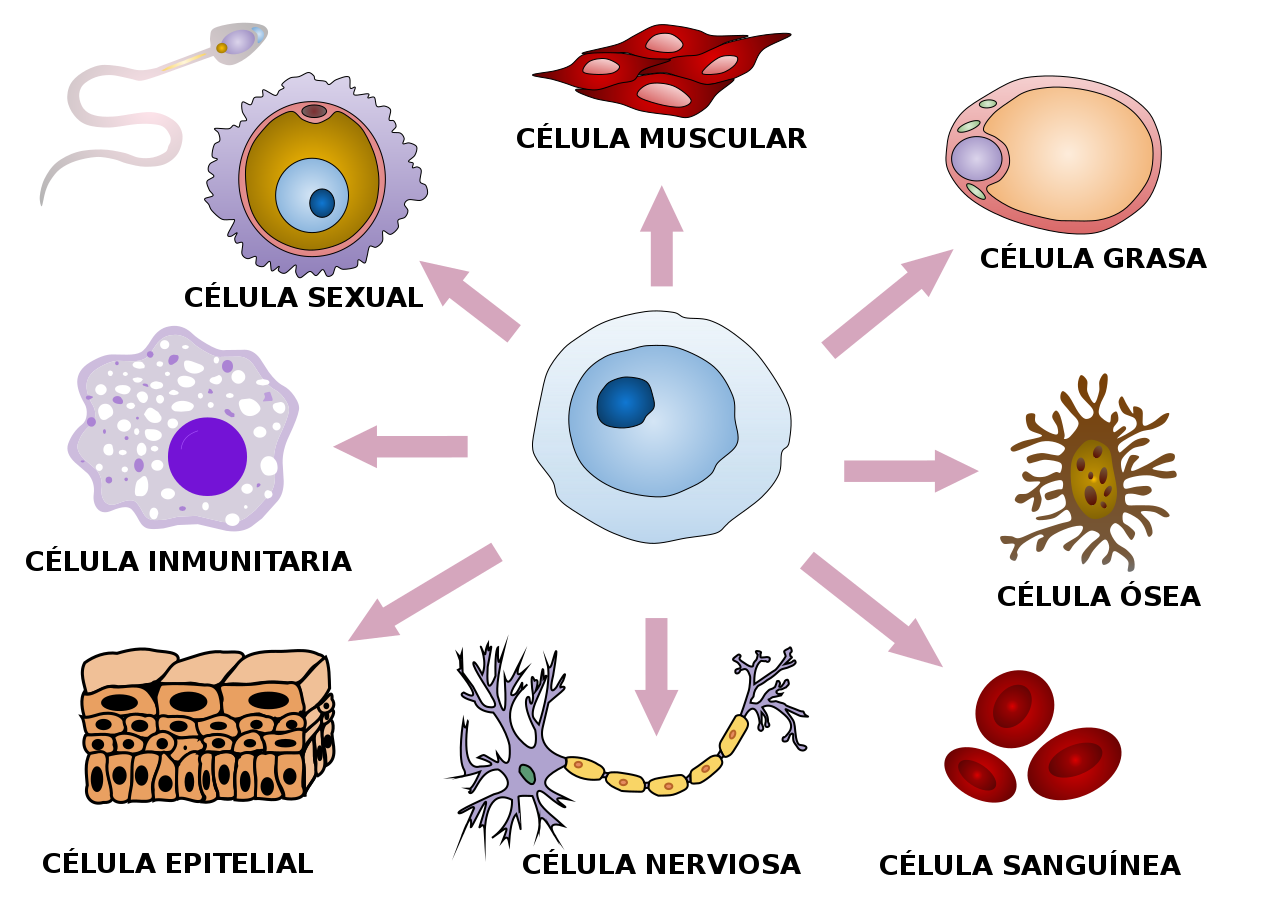
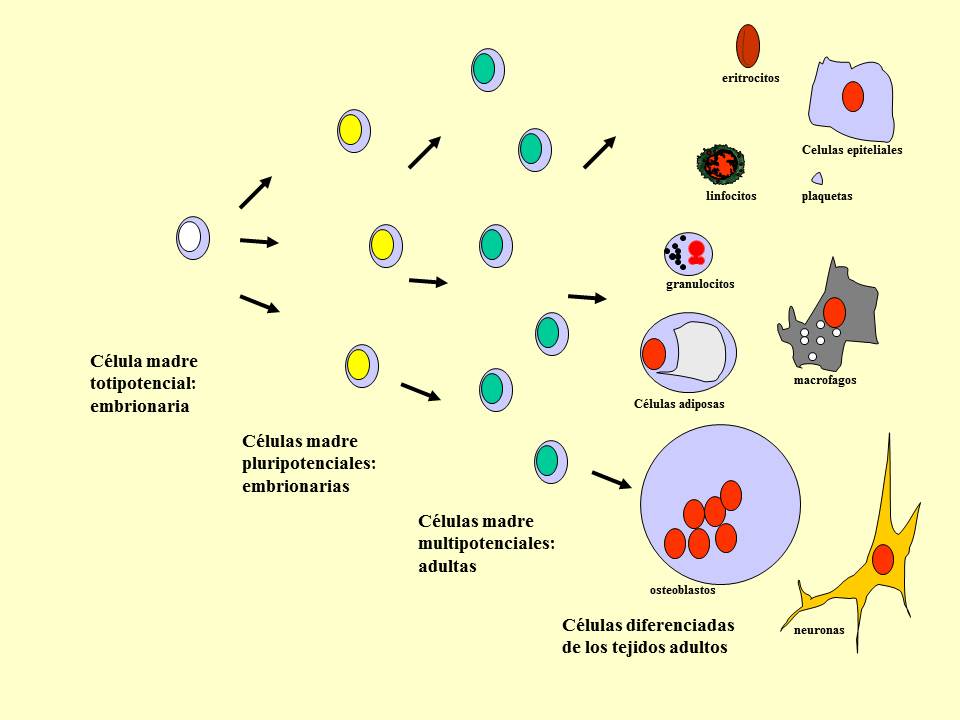
Los organismos pluricelulares, como los animales y las plantas, están formados por células procedentes de un cigoto original, que a su vez es el resultado de la fusión entre un óvulo y un espermatozoide. Ese cigoto se divide activamente produciendo un embrión que, al alcanzar entre los tres y cinco días, estará compuesto por alrededor de 150 células madre pluripotentes, lo que significa que pueden dividirse en más células madre o pueden convertirse en cualquier tipo de célula del cuerpo. Esta versatilidad permite que las células madre embrionarias tengan el potencial para regenerar o reparar tejidos y órganos enfermos.
Si el embrión continúa su desarrollo normal, se transformará en un organismo complejo gracias al proceso de especialización o diferenciación celular. A lo largo de este proceso, las células descendientes de las células madre embrionarias van cambiando, tras las sucesivas divisiones, hasta convertirse en células diferenciadas o especializadas en el cumplimiento de una función particular dentro de un sistema o tejido.
Hasta mediados del siglo pasado, se pensaba que la especialización era un hecho irreversible. O lo que es lo mismo, a medida que una célula se va especializando iría perdiendo las características embrionarias y la capacidad de generar distintos tipos celulares. Sin embargo, a partir de la década de 1960 empezó a cobrar forma un campo de estudio fascinante: se detectó que las células especializadas poseían una inesperada plasticidad. Tras diversos experimentos, fue posible cultivar en el laboratorio células especializadas y convertirlas, bajo condiciones controladas, en células madre pluripotentes inducidas, también llamadas células iPS (por sus siglas en inglés).
En suma, se logró demostrar que la especialización no es irreversible, sino que, por el contrario, las células diferenciadas sometidas a condiciones específicas de cultivo pueden recuperar su pluripotencia. Este proceso, que sería como hacer retroceder un reloj, se llama reprogramación celular, y tiene como finalidad redirigir el destino de dichas células.
Manipular de manera controlada la plasticidad celular puede suponer una revolución para la medicina regenerativa. Gran número de especialistas considera que «las células madre embrionarias inducidas son uno de los mayores objetos de deseo de la investigación médica actual; pues tendríamos a nuestra disposición la posibilidad de curar las enfermedades provocadas por la muerte de las células adultas, casos del alzhéimer, la diabetes, el párkinson y tantas otras». O sea, que con las llamadas células iPS se podría crear cualquier tipo de célula necesaria para el tratamiento de una enfermedad concreta. Tras estas conclusiones, las y los expertos afirman que «la reprogramación celular es una estrategia terapéutica con mucho futuro por delante».
No obstante, aunque en esta tecnología se sigue trabajando intensamente, aún queda mucho por saber. De hecho, hay partes importantes que no se acaban de entender del todo y ciertos mecanismos que todavía no pueden controlarse. Es precisamente en tan interesante cuestión en la que lleva a cabo su trabajo como investigadora una cualificada bióloga, Helen Margaret Blau.
Ciertamente, Blau es conocida porque ha contribuido a demostrar la reversibilidad del estado diferenciado en células de mamífero, ayudando a cambiar la noción dominante durante largo tiempo que consideraba al estado diferenciado como fijo e irreversible. Sus descubrimientos se suman a los esfuerzos para abrir nuevos y prometedores horizontes dentro de la medicina regenerativa con el objetivo de reponer las células perdidas como consecuencia de enfermedades o accidentes.
La gestación de una fructífera carrera
Helen Margaret Blau nació el 8 de mayo de 1948 en Londres, aunque tiene doble nacionalidad, británica y estadounidense. Se graduó en la Universidad de York en Inglaterra (1969) y obtuvo su doctorado en la Universidad de Harvard (1975). Después de una beca posdoctoral en el Departamento de Bioquímica y Biofísica, División de Genética Médica, en la Universidad de California, San Francisco (UCSF), se incorporó a la Universidad de Stanford en 1978. Desde 2002 es directora del Baxter Laboratory for Stem Cell Biology (Laboratorio Baxter de Biología de Células Madre).

En el año 2012, la científica escribía en la revista Nature Cell Biology un interesante artículo con ilustrativos comentarios sobre su actividad profesional. Por ejemplo, relata que «como profesora ayudante en la Universidad de Stanford durante la década de los años de 1980, y después de pasar años cultivando células y observándolas al microscopio, no podía aceptar que una vez que éstas se han especializado, su destino esté sellado para siempre». Dando vueltas al tema con pensamiento crítico, surgió en ella una pregunta que marcaría su senda como investigadora: «¿Por qué la diferenciación celular debe ocurrir en una dirección única?»
En 2010, publicaba un trabajo junto al experto en células madre Shinya Yamanaka (nacido en 1962), médico profesor de la Universidad de Tokio y premio Nobel de medicina en 2012, donde subrayaban que las células especializadas no se encuentran en un estado inamovible, sino que la diferenciación está controlada por mecanismos dinámicos que podrían modificarse y reprogramar así una célula adulta para luego redirigirla hacia otro tipo celular.
La plasticidad de las células madre
En el artículo de Nature publicado en 2012, la científica narraba alborozada que, tras múltiples intentos para cambiar el destino de una célula, sintió un profundo entusiasmo «cuando con nuestros experimentos conseguimos demostrar que el estado diferenciado “terminal” de las células humanas podía alterarse». Helen Blau apunta que «la revelación de la plasticidad del destino de una célula resultó electrizante. Comprendí que esa plasticidad podía entrar a formar parte de la lista de nuevas aplicaciones médicas. Este fue un momento decisivo de mi carrera».
La experta también describe en Nature Cell Biololgy que desde los comienzos de su carrera investigadora deseaba saber si los genes silenciosos de una célula especializada podrían activarse mediante la alteración del entorno citoplasmático que rodea al núcleo. Blau se está refiriendo a que todas las células de un organismo pluricelular poseen la misma información genética, y por tanto los mismos genes (salvo las células reproductoras y los glóbulos rojos). No obstante, a medida que las células se especializan se vuelven diferentes unas de otras.
Durante largo tiempo se había asumido que una célula al diferenciarse inactivaba permanentemente los genes que le eran innecesarios. Yamanaka y Blau, recordaban en su artículo que la visión predominante se preguntaba: «¿Por qué debería una célula especializada conservar el potencial para reactivar genes que son característicos de otro tipo celular? Mantener ese potencial podría ser arriesgado porque albergaría la posibilidad de que los genes pudieran activarse inapropiadamente».
Sin embargo, los avances de la biología molecular habían permitido demostrar que las células especializadas son distintas no porque tengan genes distintos, sino porque expresan o activan genes distintos. Como subrayaron los citados Yamanaka y Blau, «los genes de las células adultas no se inactivan permanentemente». Así, las diferencias entre, por ejemplo, un hepatocito y una neurona, no se deben a la pérdida de genes, sino a la actividad selectiva de los mismos, ya que ambas retienen toda la información genética.
La cuestión básica es, por lo tanto, cómo conseguir reactivar a los genes silenciosos para que una célula especializada recupere su pluripotencia. O lo que es lo mismo, cómo revertir el destino celular retornando una célula especializada al estado embrionario. Aquí surge la importante colaboración de Helen Blau en este ámbito; ella lo explica con meridiana claridad: «En los mamíferos, el hígado o la piel normalmente no generan músculo, pero nuestros experimentos revelaron que estas células son totalmente capaces de un cambio radical».
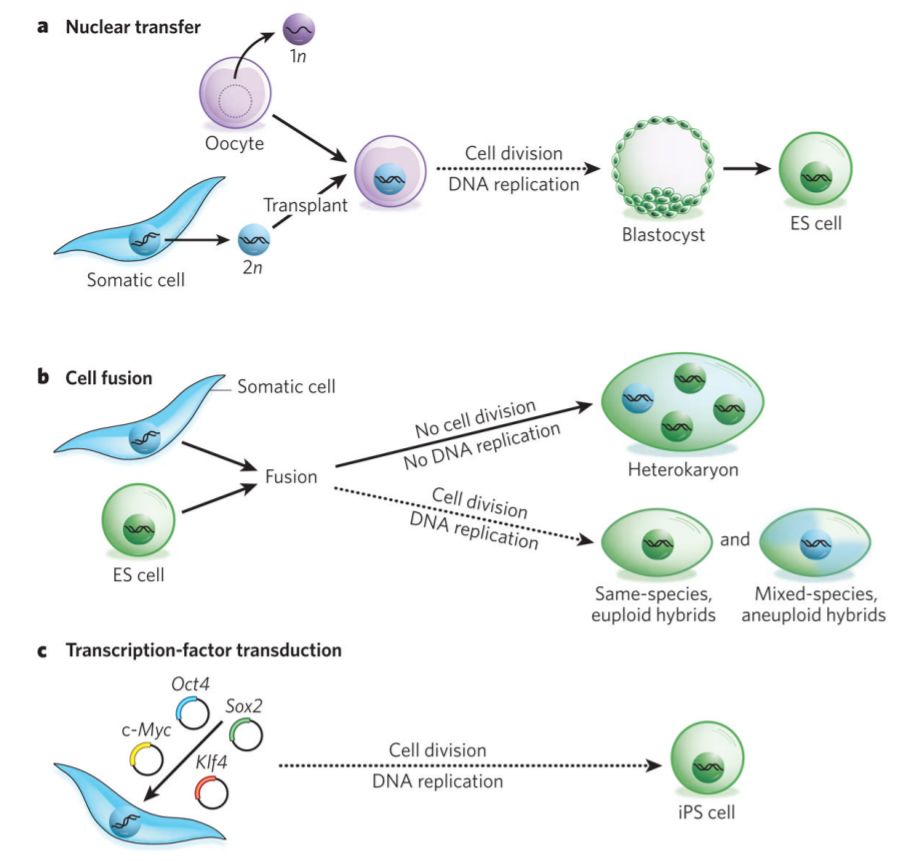
Haciendo referencia a la complejidad del tema, Blau ha expuesto que, entre las diversas técnicas experimentales que se están investigando para inducir a una célula especializada a expresar los genes que conserva silenciosos, se encuentra la fusión entre células de dos especies distintas. La científica y su equipo optaron en su trabajo por fusionar células humanas con otras de ratón. Conociendo que la dosis relativa de material citoplasmático que rodea al núcleo es el resultado de la proporción de las células fusionadas, tras diversos intentos, lograron que las células humanas recuperasen las características de una célula madre embrionaria.
Sin entrar en demasiados detalles, valga citar que el éxito, esencialmente, se debió a que el ambiente que rodea al núcleo, y que afecta a los genes de su interior, se vio modificado con la fusión, lo que provocó el resultado buscado: la activación de los genes que estaban silenciosos. Al respecto, la científica dejaba escrito que «con ayuda de sus hábiles estudiantes (llamadas por mis colegas los “ángeles de Helen”), pude ver realizadas mis esperanzas».
Ciertamente, con gran satisfacción escribiría Blau en 2012: «Recientemente, ha sido muy gratificante ver que nuestro trabajo […] se ha extendido a nuevas técnicas en reprogramación celular de mamíferos […]. Tales aproximaciones enfatizan el papel fundamental del equilibrio de los reguladores presentes en el entorno nuclear, que son los que controlan los cambios en el destino de las células diferenciadas». Insistimos, cambiando el ambiente que rodea al núcleo celular se puede conseguir que se activen genes que permanecían inactivos.
Como broche final a su breve autobiografía, Helen Blau acababa expresando que «ahora, mi sueño es traducir estos hallazgos a determinadas aplicaciones clínicas en medicina regenerativa».
Saltando barreras: el retorno social de la investigación
El «sueño» al que hace referencia Helen Blau, se inserta en lo que actualmente se llama investigación traslacional; un concepto que ha emergido con fuerza en los últimos años en el entorno biomédico. A grandes rasgos, señalan los profesores de la Universidad de Valencia, Oscar Llopis y Pablo D’Este, se trata de una investigación que «pretende explicar y reducir la enorme distancia existente entre el conocimiento básico obtenido en el laboratorio y la incidencia real que este conocimiento tiene sobre los pacientes o la sociedad en general».
Son diversos los y las especialistas que afirman que la separación entre investigación biomédica básica y su aplicación clínica no para de crecer. Pese a la explosión de conocimientos biológicos de las últimas décadas, tales logros no se han traducido en el incremento correspondiente de nuevos tratamientos derivados de los avances en investigación básica. La experiencia, como afirman Llopis y D’Este, «ha puesto de manifiesto que el retorno social de la investigación biomédica es un proceso enormemente complejo, lo que dificulta que los retornos sociales sean directos y rápidos».
La mayoría de las investigaciones en curso sobre las aplicaciones clínicas de las células madre se centran actualmente en lo que se denomina terapia celular. Básicamente, la aproximación propuesta consiste en extraer células de un paciente, reprogramándolas in vitro (en el laboratorio) hasta el estado de células madre pluripotentes. A continuación, cultivarlas bajo unas condiciones definidas para que se diferencien en el tipo celular afectado por la patología y, finalmente, trasplantarlas de nuevo a la persona enferma.
Recientemente, en 2017, los investigadores de la Universidad de la Amazonía, en Brasil, Gustavo A. Pimentel-Parra y Betselene Murcia-Ordoñez, han subrayado que esta metodología conlleva, por un lado, la enorme ventaja de poder generar cualquier tipo de célula necesaria, y por otro, no produciría un rechazo por parte del sistema inmune ya que se habrían obtenido directamente del propio paciente, y por ello tendrán la configuración genética de la persona a tratar.
Sin embargo, continúan estos autores, son muchas las cuestiones que todavía hay que resolver para que este tipo de terapias puedan ser una realidad. Un obstáculo importante, por ejemplo, se debe a que las células madre inducidas pueden generar cualquier tipo de célula, lo que es excelente para la terapia celular o de regeneración; pero también pueden producir teratomas, un tipo especial de tumores que no crece mucho y no invade, pero que son al fin y al cabo tumores. Resulta pues de suma importancia aprender a controlar el paso que viene después del proceso de reprogramación, es decir, que las células reprogramadas generen solo las células deseadas. Si se desean células neuronales, que se diferencien solo a neuronas y nada más.
En cualquier caso, Pimentel-Parra y Murcia-Ordoñéz, junto a gran parte de la comunidad de especialistas, sostienen que «no cabe la menor duda de que en un futuro el empleo de células madre contribuirá a un sinfín de tratamientos de enfermedades incurables, como las enfermedades neurodegenerativas, endocrinológicas, cardíacas, afecciones sanguíneas y una recuperación más rápida y eficiente en accidentes, implementando cultivos celulares para la reconstrucción de tejidos y órganos y una mejora en la calidad de la vida humana».
Estas expectativas representan una poderosa motivación para continuar los trabajos con células madre. De hecho, cada vez más laboratorios de diferentes partes del mundo están dedicando sus esfuerzos al desarrollo de tan novedosas terapias. Sin duda, entre los equipos más destacados se encuentra el dirigido por Helen Blau, que sigue investigando intensamente la reprogramación celular con fines terapéuticos. Sus extraordinarios resultados ponen de manifiesto, una vez más, el enorme valor y empuje que están aportando las mujeres científicas a la investigación puntera de hoy.
Referencias
- Blau, Helen M. (2012). «Redefining differentiation: Reshaping our ends». Nature Cell Biology 14, 558
- Llopis, Oscar y Pablo D’Este. «Investigación traslacional e innovación médica: el caso de las redes CIBER». Sociedad Española de Bioquímica y Biología Molecular
- Pimentel-Parra, G.A. y B.Murcia-Ordoñez (2017). «Células madre, una nueva alternativa médica». Science Direct
- Scudellar, Megan. «Una década de reprogramación celular». Investigación y Ciencia, octubre 2016
- Yamanaka, Shinya and Helen M. Blau (2010). «Nuclear reprogramming to a pluripotent state by three approaches». Nature. 465 (7299): 704–712
Sobre la autora
Carolina Martínez Pulido es Doctora en Biología y ha sido Profesora Titular del Departamento de Biología Vegetal de la ULL. Su actividad prioritaria es la divulgación científica y ha escrito varios libros sobre mujer y ciencia.
2 comentarios
Meravollos artícle, vocabulari comprensible, motivador, permet captar la il·lusió de la investigadora i l’emocioó que suposa la confirmació de una hipotesis aixi com permet cpmpendrecom treballa la ciència. L’utilitzaré amb l’alumnat més interessat dels meus grups de 4 eso.
Hola Carme
Muchas gracias por tu comentario. Me alegra que te haya gustado, pero aún me alegra más el que uses esta entrada con tus alumnas y alumnos. Espero que les guste y estimule su interés por la ciencia.
Un cordial saludo
Carolina