Françoise Barré-Sinoussi: «Nos hemos relajado en la lucha contra el sida»

Françoise Barré-Sinoussi (París, 1947). Directora de la Unidad de Regulación de Infecciones Retrovirales del Departamento de Virología del Instituto Pasteur en París. En 2008, fue galardonada con el Premio Nobel de Medicina junto con Luc Montaigner por el descubrimiento del Virus de Inmunodeficiencia Humana (HIV).
Apenas seis meses después de recibir el Premio Nobel de Medicina 2008, Françoise Barré-Sinoussi visitó Bilbao para exponer sus descubrimientos en el marco del ciclo de conferencias Nutrición y Salud, organizado por cic bioGUNE y la Fundación BBVA. En su apretada agenda, tuvo la deferencia de charlar con Fabienne Aillet de la unidad de proteómica de CIC bioGUNE para CIC Network sobre la situación actual de la investigación del HIV, de ofrecer su visión de la lucha contra el sida y de compartir sus inquietudes sobre los retos científicos del futuro.
Después de su tesis doctoral y de su postdoctorado en la agencia norteamericana National Institutes of Health, en 1975 emprendió su carrera en el Instituto Pasteur, concretamente en el Departamento de Virología. El descubrimiento del virus del sida en 1983 fue un momento crucial en su vida, tanto a nivel profesional como personal. ¿Qué recuerda de aquella época?
Efectivamente, fue un momento crucial de mi vida. El descubrimiento del sida marcó un antes y un después en mi carrera científica. Los programas de investigación empezaron a ser enfocados desde otra perspectiva. Antes del descubrimiento del virus HIV/sida trabajaba, al igual que otros muchos investigadores, en un laboratorio que basaba sus objetivos de investigación sobre ejes que nos parecían interesantes, pero sin ser del todo conscientes de las expectativas de los pacientes y de los médicos.
El HIV/sida implica precisamente una fuerte interacción con el ámbito médico así como la llegada de enfermos al Instituto Pasteur y las visitas a enfermos en los hospitales. Al escucharles me di cuenta de que las prioridades que nos fijamos no siempre coinciden con las de los pacientes, sino más bien de los clínicos.
Es probable que ello nos haya llevado a reforzar las investigaciones relacionadas con las interacciones virus-paciente, su patogénesis y el mecanismo de la patogénesis para saber más sobre esos mecanismos y así definir una estrategia de vacunación y terapéutica mejorada. Y esas estrategias se deben llevar a la práctica.
Cuanto antes, supongo.
¡De inmediato! Cuando nos enfrentamos a una enfermedad que en su día fue mortal, las estrategias deben aplicarse lo antes posible. Por otro lado, el descubrimiento de la realidad de los países en vías de desarrollo fue muy importante para mí, porque en ellos pudimos poner en práctica estrategias realistas desde el punto de vista económico. ¿Qué he descubierto? He descubierto algo para lo que fui educada en el Instituto Pasteur, que nosotros llamamos «misiones pasteurianas»: investigación fundamental para las aplicaciones de la investigación, asociando la formación mediante la investigación en los países más afectados, incluidos los países más pobres. Me formaron para esto, pero hasta que no se ve a qué corresponde exactamente esta visión es imposible ponerla en práctica. Ése fue el momento en el que descubrí lo que significaba la «visión pasteuriana». Y me uní a ella de manera incondicional.
Una actitud muy profesional por su parte…

La investigación multidisciplinar está muy de moda. Lo cierto es que Louis Pasteur fue un visionario. Tuvo que percatarse de la necesidad de un enfoque multidisciplinar, de centrarse en aplicaciones, de enviar a sus discípulos a los lugares afectados. Todo eso hoy nos resulta trivial, pero durante años no lo fue.
Lo sorprendente es que en esa época pocos pacientes presentaban en Francia o en Europa un cuadro clínico marcado por la inmunodeficiencia…
Unos cincuenta.
Eso es, unos cincuenta. ¿A qué se debió una investigación tan frenética? ¿Por qué se decidió investigar sobre este tema? Se podía haber aducido que no afectaba más que a unos pocos pacientes. Sabemos que el tema cobró una gran importancia. ¿Por qué dedicaron tanto tiempo a buscar el virus en estos pacientes, cuando otros pacientes presentaban otro cuadro clínico que no requería una investigación tan frenética como la del sida?
La cuestión es que el virus había afectado a la población joven. Insisto en que fueron los clínicos quienes llamaron a nuestra puerta. Para un clínico resulta demoledor ver a pacientes tan jóvenes «caer como moscas» y morir de forma tan rápida. En esa época –ahora ya no–, los pacientes nos recordaban las figuras de los campos de concentración. Estamos hablando de pacientes muy jóvenes, de unos treinta años. Es muy duro presenciar ese tipo de injusticias. No se puede dejar morir a gente tan joven.
¿Había muchos enfermos en esa época en París?
Unos cincuenta. En los Estados Unidos había muchos más.
Tenía que haber alguna explicación…
Sabíamos que era un virus que se transmitía por vía sanguínea, por vía sexual y por vía vertical, de madre a hijo. Y eso ya nos preocupaba. Cuando hablo de la sangre me refiero también a sus derivados. El hecho de que en 1982 se detectaran los primeros casos de hemofílicos nos llevó a involucrarnos aún más. Decidimos poner fin a la catástrofe. Sabíamos que, al tratarse de un agente que se transmitía a través de las transfusiones de sangre, que a su vez se había transmitido por derivados sanguíneos, sólo podía tratarse de un virus. Teníamos que identificar el virus lo antes posible, para evitar que llegara a ser una auténtica hecatombe. La juventud tenía que saber que se trataba de una enfermedad de transmisión sexual, sanguínea y vertical, porque ya se habían detectado los primeros casos de niños infectados.
Descubierto el virus, se emprendió una desenfrenada carrera que dio lugar a la realización de test de diagnóstico, a la secuenciación del virus, a los tratamientos y a la investigación de base. Un equipo de trabajo increíble. ¿Ha habido alguna persona que de alguna forma haya marcado su vida, una especie de guía?
Sí. Mi primer guía fue sin duda Jean Claude Chermann. Fue el primero que me abrió las puertas de su laboratorio siendo yo aún estudiante. Estaba en tercero de carrera. Quería trabajar en un laboratorio, porque sentada en los bancos de la facultad no aprendía mucho sobre investigación. Decidí, con el consentimiento de mis padres, buscar un laboratorio que me contratara a tiempo parcial mientras proseguía mis estudios en la universidad. Él fue el único que me abrió sus puertas. En esa época no solía ser muy habitual trabajar con alumnos que no habían acabado la carrera. Me contagió su gran entusiasmo, su pasión por la investigación y, en particular, su visión sobre las «misiones pasteurianas». Además, se dedicaba a un ámbito que resulta muy atractivo cuando se es joven: leucemias, cáncer, relaciones retrovirales… Era una época en la que se investigaba mucho sobre el cáncer. Para un joven es muy tentador pensar que puede aportar algo en la investigación sobre el cáncer. También descubrí la pasión. En lugar de asistir a las clases de la facultad, me pasaba todo el tiempo en el laboratorio, y mis compañeros me pasaban los apuntes para poder presentarme a los exámenes.
Es una lástima que el señor Chermann no comparta el premio, como reconocimiento a su trabajo, a su pasión…
Confieso que es una de las primeras personas en las que pensé cuando me dieron la noticia, y que en cierto modo me dolió. Es cierto que la decisión la toma el Comité, pero no sé por qué…
No puede haber más de tres o cuatro premiados…
Más de tres. Bueno, así son las cosas. En cualquier caso, el hecho de nombrarle en todo momento me permite compartir el premio con él. Hay otra persona tremendamente importante para mí. Bueno, en realidad son tres. En el laboratorio de los Estados Unidos donde cursé mi postdoctorado conocí a Robert Bassin. En cierto modo me ayudó a completar mi formación en retrovirales, concretamente sobre la restricción de la aplicación de retrovirales en las células (la famosa restricción lv1), que como bien sabemos también es importante en la infección por HIV con factores estereotipados trim5-alfa. Fue él quien me enseñó lo que era el rigor científico y hasta qué punto había que ser riguroso. La tercera persona a la que admiro y seguiré admirando es Jean-Paul Lévy. Es un hombre de una gran sabiduría científica con conocimientos artísticos y filosóficos envidiables.
Han transcurrido 25 años desde el descubrimiento del virus HIV. Dada la expansión de la epidemia, se han realizado grandes inversiones, humanas y económicas para su investigación en todo el mundo, que han contribuido a aumentar los conocimientos sobre los retrovirales, sobre las interacciones virus huésped y sobre el sistema inmunitario del ser humano. Pero la epidemia no ha desaparecido. ¿Cree usted que algún día conseguiremos controlarla?
Soy optimista al respecto, porque a nivel internacional nos seguimos esforzando en facilitar el acceso al tratamiento a todas las personas. Gracias, particularmente, a los fondos mundiales de las Naciones Unidas hemos progresado mucho en este ámbito. En cinco años hemos conseguido que alrededor de un 30% de las personas infectadas estén bajo tratamiento en los países más desfavorecidos. Cierto es que aún queda un 70%, pero hace cinco años sólo se registraba un 2% de los pacientes. El avance es, por tanto, considerable. Estos tratamientos aportan un gran beneficio personal al paciente, pero también al colectivo, al disminuir la cantidad de virus, de cargas virales en los pacientes, incluso la carga viral en las moléculas genitales –no en todos los casos, pero sí en gran parte–.
En suma: estos pacientes transmiten el virus en menor medida que los pacientes que no se encuentran bajo tratamiento. Yo creo que los antirretrovirales no sólo van a ser beneficiosos para el tratamiento, sino que además ayudarán a ralentizar, a disminuir la epidemia a nivel mundial.
A través de estos tratamientos relativamente eficaces, los pacientes afectados por el HIV pueden llevar una vida normal, pese a tratarse de una infección crónica. ¿Cree usted que, en caso de mermarse los esfuerzos dirigidos a la prevención, la epidemia se volvería a propagar?
Seguro. De hecho, es lo que sucede. Hace poco he oído unas cifras inquietantes. Las tuve que oír dos veces, porque no daba crédito: en Washington, el 3% de los ciudadanos están infectados por el HIV. Más que en Dakar o en Senegal, por ejemplo.
Eso es exactamente lo que iba a decirle. Se trata de un porcentaje sorprendente.
Es motivo de preocupación el ver que, pese a todos los esfuerzos que se invierten en la educación y en la información, aún queda mucho por hacer en el ámbito del HIV/sida. Nos hemos relajado. Tengo la sensación de que, desde que existe la posibilidad de recibir tratamiento, mucha gente dice: «¿Por qué preocuparnos por el sida? Se recibe tratamiento y ya está».
Creo que el público en general no ha llegado a entender que se trata de un tratamiento de por vida, de un tratamiento difícil, aunque las cosas se hayan simplificado en lo que a protocolo terapéutico se refiere. Un alto porcentaje de pacientes bajo tratamiento sufre a largo plazo repercusiones dramáticas: cáncer, trastornos del metabolismo de las grasas con lipodistrofias estéticamente desagradables que, además, afectan a los órganos vitales como el corazón, provocando crisis cardiacas y trastornos del sistema nervioso central. Además, la enfermedad de Alzheimer se manifiesta en pacientes de corta edad. Se trata en efecto de una proporción reducida en relación al conjunto de pacientes, pero nunca se sabe quién padecerá dichos trastornos y complicaciones. Nadie lo sabe. Creo que es importante informar a la población, para que sean conscientes de que el tratamiento para los infectados por el sida no es tan sencillo como imaginan. Lo que también resulta muy preocupante es que a muchas personas se les detecta la enfermedad por pura casualidad, como, por ejemplo, a mujeres embarazadas y a sus parejas cuando se someten a un test prematrimonial, o cuando sus mujeres dan positivo.
Considero imprescindible divulgar la información para que la gente sienta la necesidad de someterse a los test de diagnóstico de la enfermedad de forma sistemática. Hay que explicarles que antes no podían hacerlo porque no había tratamiento, pero ahora sí. Se les puede decir, por ejemplo, que cuanto antes se les diagnostique la enfermedad, antes podrán empezar a aplicar el tratamiento. Y eso redunda en su beneficio. Cuando la eficacia de los tratamientos era aún dudosa, resultaba difícil animar a la gente a que se sometiera a los test.
Me hablaba del caso de Washington, donde el 3% de la población está infectada. Me parece increíble. Se trata de un porcentaje similar al de los casos de epidemia de los países pobres. Los principales afectados son personas que rondan los cuarenta años. Seguramente se trate de personas que empezaron a tener relaciones sexuales en los tiempos en que el sida empezaba a manifestarse. Y al haber mermado los esfuerzos en la prevención, se conforman pensando que su mal tiene tratamiento. Se ha bajado la guardia en términos de prevención, y eso ha traído consigo un nuevo brote de la epidemia. Es realmente preocupante.
Lo vemos también en Francia, sobre todo en el caso de los homosexuales, que empiezan a actuar con negligencia…
Se han relajado…
Sin embargo, la sociedad en la que vivimos ama el riesgo. Hay cada vez más aficionados al paracaidismo y a las emociones intensas en general. Algunos simplemente dicen «Me voy a arriesgar, y luego ya se verá. Total, habiendo un tratamiento, tampoco será tan dramático que contraiga la enfermedad». Son aspectos que hay que tener en cuenta. También me preocupa ver que en la población homosexual francesa –aunque no sólo en Francia– está pasando lo mismo. Se empieza por los homosexuales y luego se sigue con los jóvenes. Los jóvenes también han empezado a bajar la guardia al respecto…
Muchos de los que mantienen sus primeras relaciones sexuales ignoran las posibles consecuencias del sida y creen que se trata de una enfermedad de otra generación.
Y esto es muy preocupante. Hay que ser muy cuidadosos con las campañas de información y de educación.
Al tratar con los homosexuales me ha dado la sensación de que están cansados del tema. En París, por ejemplo, se percibe un cierto hastío. Ya no usan preservativo; están hartos. Simplemente piensan que hay un tratamiento y que la enfermedad se volverá crónica. Y punto. Es espeluznante.
Lo es.
El mayor número de personas infectadas por el virus del sida se concentra en el África subsahariana. También en Asia es muy elevado el porcentaje de infectados. Usted, en calidad de científica, ha colaborado en estos países con el fin de establecer un sistema de detección, prevención y seguimiento de la enfermedad. ¿Ha tenido usted que enfrentarse a dificultades de índole política, cultural o ideológica en África o Asia?
Sí. En algunos países, de todos modos, ha sido más «fácil» –fácil entre comillas, porque de primeras no lo ha sido tanto– desarrollar programas de cooperación e investigación. En esos países no cabe iniciar investigaciones sin plantearse un seguimiento de los pacientes. Y en el caso de los países con escasa voluntad política, todo se complica muchísimo: se tarda mucho más en conseguir los permisos, etc. Algunos programas no se llevan a cabo por la sencilla razón de que se carece de voluntad política para intervenir, ya sea para prevenir la infección de madre a hijo, ya sea para tratar a los pacientes. En algunos países hemos intervenido por medio de ONG que empezaban a suministrar tratamientos terapéuticos.
Pero todo eso resulta extremadamente complicado ante la ausencia de voluntad política. Además, en algunos países la prostitución y la droga están prohibidas, y es precisamente en esos círculos donde más afectados hay. Esto supone un problema a la hora de realizar estudios sobre las poblaciones vulnerables, porque las autoridades, los ejércitos o la policía podrían servirse de ellos para detener a los afectados. Ante este tipo de obstáculos, en ocasiones hemos llegado a desistir, incluso habiendo obtenido resultados interesantes.
Nuestra posición era clara: «No, no y no. Nos negamos a ir en busca de los pacientes siguiendo el procedimiento de estos países. Nosotros no trabajamos así. Es una lástima, pero preferimos abandonar la investigación». A veces nos encontramos con situaciones un tanto complicadas. Aún así, hay que seguir luchando.
Lo que le acabo de contar ocurrió hace unos años en Vietnam. Ahora las cosas han cambiado, se están creando centros de distribución de metadona en el país. Se trata de luchar, de ayudar a las autoridades de estos países a cambiar sus normativas y directivas.
Es por una buena causa. Los gobiernos deben saber que estamos para ayudarles, que estamos ante un problema de salud pública.
Exactamente. Creo que es importante que entiendan que existe un riesgo para el conjunto de la población. En muchos países aún se producen estigmatizaciones y discriminaciones. De hecho, ocurre también en Francia…
No hay que ir demasiado lejos para verlo.
Bueno, dependiendo de la zona, se ve en mayor o menor medida, pero sucede en todas partes. Es inaceptable. A la gente le suelo preguntar si adopta esa misma actitud con los enfermos de hepatitis B.
El sida siempre se relaciona con el sexo, cuando en realidad…
Pero la hepatitis B se contagia exactamente de la misma manera que el HIV.
Cierto. Es un problema de mentalidad…
Tiene que ver con quienes fueron los primeros infectados: los homosexuales, los drogadictos, los marginados de la sociedad… Aquellos de los que nadie quiere oír hablar. Es inaceptable.
Le voy a hacer unas preguntas de carácter más científico, a propósito de los proyectos que su unidad desarrolla en el laboratorio. Está investigando la interacción virus-huésped en el organismo y presta también especial atención a los mecanismos de resistencia y de protección natural del huésped contra el virus HIV-1. Por lo tanto, una de las dificultades a las que se enfrenta es la de trabajar con células primarias humanas o animales, lo que no siempre resulta fácil.
En un primer momento trabajó con un modelo que considero fundamental para entender esta patología: el modelo de protección natural contra la infección SIV en el simio verde de África. Estos monos infectados de forma crónica presentan una replicación viral elevada sin activaciones de las células T. ¿Cabe la posibilidad de que algún tipo celular del sistema inmunitario o factores solubles estén implicados en la inhibición precoz de la activación de las células T?
Empezamos a tener pistas. Durante los primeros días posteriores a la infección, el equilibrio entre las citoquinas inflamatorias y antiinflamatorias en los monos africanos difiere mucho del existente en el modelo patógeno o en el ser humano. La balanza se inclina a favor de las citoquinas antiinflamatorias. Esta observación ya ha sido publicada. Desde hace poco sabemos también que la captación de células dendríticas plasmacitoides es menor en los monos africanos que en los modelos patógenos, debido a una detección de interferón alfa que segrega una gran cantidad de células de este tipo, y que también está presente en el modelo patógeno, aunque en menor cantidad.
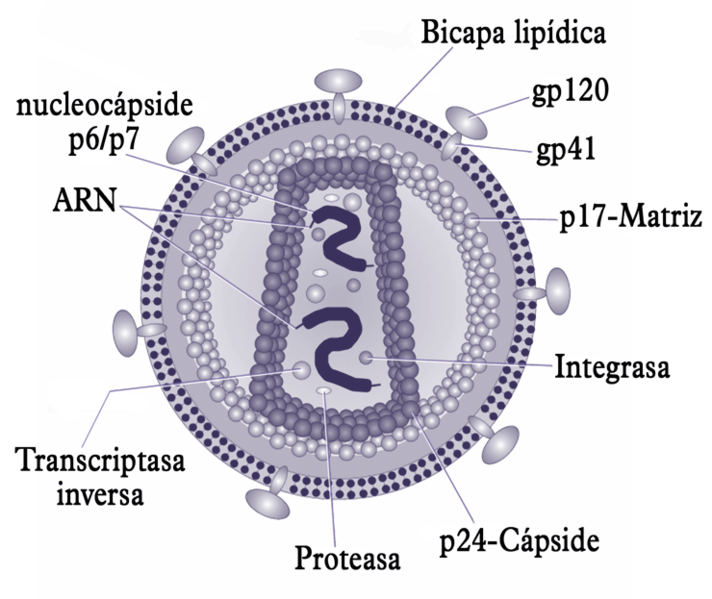
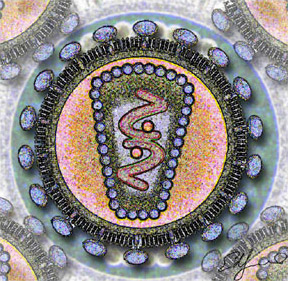
humano (Wikipedia).
Así pues, el interferón alfa cumple un papel crucial…
Sí que tiene algo que ver. Lo estamos viendo a través de estudios por microarrays. Vemos que en ambos casos existe un aumento de los genes estimulados por el interferón alfa en las células CD4+, pero en comparación con los monos de Asia –especialmente el macaco infectado por el SIV–, dicho aumento sólo se observa de forma transitoria en los monos africanos. Por lo tanto, de cara al futuro hay que tener en cuenta la pista de la activación del interferón por vías TLR. Pese a que no es nuestra labor, sino de otros equipos, también hay modelos en el mono de África; es decir, patógenos, que indican claramente que, al igual que en el hombre, se produce una depleción masiva de las células CD4+ en la mucosa intestinal. La diferencia entre los monos africanos y los modelos patógenos es que no se produce ninguna translocación microbiana al dosificar el LPS en el plasma. La cantidad de LPS se mantiene estable en los monos africanos no patógenos, pero aumenta en el ser humano, en los modelos patógenos. ¿Por qué motivo?
Estamos ante el dilema del huevo y la gallina. ¿Acaso esto explica la activación normal que se produce en los modelos patógenos frente a la activación moderada, no anormal, que vemos en la fase crónica de infección en los modelos no patógenos? Es posible, pero puede que sea una mera consecuencia. ¿De qué se trata, entonces? ¿De la causa o de la consecuencia? Por el momento no está claro.
Hay, además, otro punto: cuando se produce una infección no patógena en los monos, se produce un equilibrio entre las células TH17 que producen IL-17 en el intestino, mientras que en los casos de infecciones patógenas se observa una disminución de las células TH17. Todo esto está por comprobar. Es importante estudiar la reacción de los primeros días tras la exposición al virus en diferentes compartimentos, ya que la sangre no siempre esclarece lo que ocurre en los compartimentos linfoides. El intestino y los demás órganos linfoides son sumamente importantes (ganglios, etc.).
También está involucrada en otros proyectos en los que colaboran diversos centros de investigación, como por ejemplo en Vietnam. Su equipo realiza estudios sobre individuos de distintas poblaciones expuestas al riesgo de infección que, sin embargo, no presentan ningún síntoma, pese a llevar varios años en tal situación. Se trata de los llamados «expuestos no infectados». Han demostrado que la actividad de ciertas células del sistema inmunitario de estas personas, las Natural Killer (NK), es más intensa. ¿Esta nueva pista sobre dicho tipo de células abre nuevos horizontes en la investigación?
Desde luego. Dejamos de analizar los individuos expuestos no infectados por las razones que le comentaba, porque se trataba de una población vietnamita de drogadictos que se dividía en grupos de infectados y en grupos de no infectados. No resultaba fácil hacer un seguimiento de estos pacientes atendiendo a las modalidades vietnamitas, con lo cual decidimos abandonar el proyecto. De todos modos, creo que la actividad de las NK es mucho más intensa en el caso de las personas expuestas no infectadas.
Del mismo modo, la identificación de un repertorio de células NK diferente en las personas expuestas no infectadas frente al de los pacientes infectados o incluso de los donantes de sangre vietnamitas nos ha llevado a preguntarnos qué función desempeñan las células NK en la protección, tanto contra la infección como contra la evolución hacia la enfermedad del sida. Así pues, desarrollamos un proyecto en el laboratorio, centrándonos principalmente en el estudio in vitro, en el ecocultivo de las células dendríticas y de las células NK, para estudiar las anomalías en las señales y diálogos entre las células NK y las células dendríticas infectadas. Nos planteamos lo siguiente –razón por la cual este proyecto forma parte del programa francés de investigación sobre las vacunas–: ¿qué diferencias hay en las señales de las células dendríticas infectadas, las células dendríticas propulsadas por antígenos que se utilizan para la vacunación y las células NK? En cuanto a las primeras, se han publicado resultados interesantes. Por ejemplo, hemos observado que cuando se infectan células dendríticas que están en contacto con una subpoblación de células NK que expresan el receptor CD85J, se llega a controlar la multiplicación del virus en las células dendríticas infectadas.
Prometedora observación.
En efecto. Hemos descubierto que no se debe a la eliminación de células dendríticas infectadas por la actividad citotóxica de las células NK que expresan el receptor CD85j, sino que se trata de un control de la replicación del virus en células que estaban probablemente vinculadas a una señalización entre el CD85J y su ligando en la célula dendrítica infectada. Ahora bien, este ligando no es a primera vista el ligando clásico de las células que están en la superficie de las células dendríticas que, a su vez, son moléculas HLA clase 1, y no somos capaces de eliminar del todo la inhibición inducida por las poblaciones NK CD85J. En cambio, se consigue eliminarla completamente si se incuban o preincuban las células dendríticas con las moléculas CD85J recombinantes. Eso nos lleva a pensar en la posibilidad de que haya otro ligando que aún no ha sido identificado.
Pensar en una vacuna terapéutica puede ser interesante.
Por eso seguimos la pista e intentamos contribuir con nuestros conocimientos al desarrollo de una futura vacuna terapéutica.
También son conocidos los controladores del HIV, individuos infectados que controlan la infección a la perfección.
Se trata de un modelo complementario al mono verde.
Así es. Es un modelo muy interesante. Además, se ha demostrado el importante papel que desempeñan los linfocitos T citotóxicos CD8 capaces de bloquear la replicación viral y de eliminar los CD4 infectados. ¿Sabe usted qué reconocen estas células? ¿Cómo se produce este bloqueo?
El bloqueo se traduce claramente en la eliminación de las células infectadas por una subpoblación de células citotóxicas CD8+ que resulta especialmente efectiva en este tipo de pacientes. Es un modelo muy interesante. Porque, en realidad, ¿qué es la enfermedad del sida hoy en día? Por un lado está relacionada con la infección y la diseminación del virus y, por otro lado, con la anomalía en la activación del sistema de las células de la inmunidad. He aquí los dos componentes principales.
En el código de los monos verdes no existe anomalía en la activación, pero sí una replicación. Nos centramos en lo siguiente: ¿qué puede proteger la activación anormal de las células de la inmunidad? En el modelo de los controladores del HIV ocurre prácticamente lo contrario. Ni se disemina ni se controla la infección, pero hay un cierto nivel de activación de las células de la inmunidad que no es tan alto como en los sujetos que evolucionan hacia el sida, pero ahí están.
Y tienen una carga viral…
Tienen una carga viral que a nivel periférico está totalmente controlada. En estos sujetos no se detecta ningún ARN plasmático. Aunque se consigue detectar el virus en el genoma de las células. Y, claro está, hemos empezado a dividir a los controladores del HIV en dos grupos –se tendrá que testar en el laboratorio–. Están los progresores y los no progresores o progresores lentos. Los no progresores o progresores lentos son los controladores de HIV que cuentan con una subpoblación de células CD8+ capaz de eliminar rápidamente las células CD4. Los progresores tienen una actividad CD8+ mínima y supresora, pero relativamente moderada.
Nos hemos dado cuenta de que los que mejor controlan la infección son los no progresores o progresores lentos. De hecho, los otros registran rebrotes o aumentos transitorios de la carga viral (conocidos como blips), acompañados de una estimulación antigénica en las células CD8+ que justifica su gran actividad supresora, mientras que los otros son indetectables y no registran blips. Lo que ahora nos interesa descubrir es la razón por la cual los no progresores o progresores lentos controlan la infección. Hay que marcar una clara diferencia entre estos dos grupos. Seguramente existan factores genéticos comunes, ya que se ha demostrado que la mayoría de estos pacientes, aunque no todos, son HLA-B27, HLA-B57. Por lo tanto, no todo se explica a través de HLA-B27 y HLA-B57.
Sabemos que la respuesta celular CD8+ (CD8 eficaz) se dirige principalmente a los epítopos GAG. Ahora queremos entender las señales ascendentes que ofrecen a los controladores una respuesta de inmunidad celular eficaz. Por eso, hemos empezado a estudiar las células dendríticas y las células NK de estos pacientes, para terminar de relacionar los diferentes temas que he tratado.
Eso es. Las células NK están un poco por todas partes.
De todos modos, cabe destacar que, en el laboratorio, nos centramos sobre todo en ellas.
Algunos individuos gozan de un modelo de protección natural. Se dedican también a estudiar los mecanismos implicados en el control natural de la infección HIV en la transmisión de madres a hijos. Las células trofoblásticas humanas representan una barrera contra el huésped que resiste de forma natural a la infección por partículas virales HIV-1. ¿Existen factores o poblaciones celulares que desempeñen alguna función en esta resistencia?
En los estudios que ha desarrollado Elisabeth Menu, investigadora del Instituto Pasteur, se insiste en el equilibrio entre la citoquina inflamatoria y antiinflamatoria en la placenta, mediante modelos de estudio de reconstitución in vitro de la barrera placentaria, así como con estudios en cohortes madres-hijos de moléculas antirretrovirales para prevenir la transmisión vertical.
Llevamos a cabo el seguimiento de una cohorte de pacientes camerunesas cuando la única intervención terapéutica que existía en el momento del parto era la Nevirapina. Tuvimos acceso a una cohorte tailandesa en la que se trataba a los pacientes con AZT durante los meses de embarazo y con Nevirapina durante el parto. También estuvimos en una cohorte francesa en la que se administraba triterapia a la mayoría de las madres durante el embarazo. En estos tres tipos de cohortes obtuvimos los mismos resultados que con el tratamiento in vitro, y demostramos que los antirretrovirales y el AZT –ambos con su propia función en la replicación viral– también desempeñan un importante papel a la hora de proporcionar un equilibrio a favor de las citoquinas antiinflamatorias. En cambio, las citoquinas inflamatorias como el TNFA estimulan la activación de NF-KB. Nos volvemos a concentrar en mecanismos de activación que hay que tener presentes.
Cuando realizamos un estudio con una molécula antirretroviral, nuestros colegas cameruneses nos comunicaron que en su cohorte de madres siempre administraban Nevirapina en el parto, y que, para nuestra sorpresa, no preveían la transmisión de madre a hijo mediante la misma cuando los nacimientos se producían en los tres meses –si no recuerdo mal– que duraba la estación de las lluvias. Les indicamos que si el embarazo se había desarrollado durante la estación de las lluvias, podían aparecer síntomas de paludismo en los niños, y, por tanto, coinfecciones del HIV y del paludismo. De hecho, los niños se infectan estando en el útero, por lo que la Nevirapina deja de surtir efecto en el momento del parto. Acabamos de empezar a estudiar la posibilidad de que existan antígenos, o más bien fragmentos de antígenos Plasmodium falciparum que provoquen la infección. Y sí, los hemos detectado en los modelos de reconstitución in vitro.
Y volvemos a lo mismo. El famoso antígeno Plasmodium falciparum incrementa el TNFa y, portanto, aumenta la replicación del virus.
¿Cómo deberían actuar? ¿Aplicando un tratamiento de Nevirapina?
Podrían recurrir a los tratamientos que se aplican en los países industrializados. Por lo menos, deberían administrar AZT u otros antirretrovirales durante el embarazo, y la Nevirapina en el parto. Y, por supuesto, un tratamiento de prevención contra el paludismo.
El trabajo de campo nos permite observar que, en todos estos países, además de casos de infección de HIV, hay también coinfecciones.
Todas las coinfecciones posibles. Sin olvidarnos de la tuberculosis…
Otro caballo de batalla que debía haberse erradicado hace tiempo.
La tuberculosis nos interesa también en lo tocante a la inflamación y a la activación. Contamos con una elevada proporción de infectados, porque los estudios llevados a cabo en los países en desarrollo indican que entre el 15 y el 30% de los pacientes coinfectados del HIV y de tuberculosis que llega a una fase muy terminal en los hospitales recibe fármacos antituberculosos y antirretrovirales contra el HIV, sufre el síndrome de reconstitución inmunitaria del HIV, incuba la tuberculosis y muere de ella, incluso bajo tratamiento antirretroviral.
De todos modos, prácticamente no sabemos nada sobre los mecanismos de los síndromes de reconstitución inmunitaria. El estudio ha sido realizado directamente en Camboya por un investigador nativo que ha centrado su tesis en este tema, con el fin de indagar en el rol inmunitario innato de las células NK en los síndromes de reconstitución inmunitaria en pacientes coinfectados por el HIV y la tuberculosis.
No resulta fácil tratar separadamente estas enfermedades en los casos de coinfección. Ya por último, me gustaría prestar atención a los macrófagos, depósitos para el virus que mantienen la persistencia viral y cumplen una función crítica en la infección. Se ha demostrado que es posible bloquear la infección HIV-1 en estas células tras haber agregado receptores activos fcyriia. Esta inhibición concierne al virus HIV-1, pero también a otros lentivirus como son los virus HIV-2, SIV Mac y SIV Agm. ¿Se ha podido describir algún mecanismo de acción responsable de la inhibición? ¿Ha sido identificada alguna proteína común a las diversas estirpes virales?
Lo único que sabemos a día de hoy es que se están llevando a cabo estudios sobre la función controladora de las proteínas de tipo VPU y VPR. Es interesante estudiar los depósitos, que son los responsables de que la infección se vuelva crónica. Su función es cada vez más importante…
Es cierto que el macrófago es un depósito, pero creo sinceramente que el depósito más importante en la infección del HIV es el linfocito t CD4+ en reposo. El macrófago también está infectado, pero menos que el linfocito T CD4+ quiescente. Hay que tenerlo en cuenta, claro, pero…
No tanto como se pensaba en un primer momento.
Hay que tenerlo presente especialmente en el caso del sistema nervioso central. Pero está claro que ante la presencia de células infectadas de tipo macrofágico o de células dendríticas, éstas pueden favorecer la infección de los linfocitos T, por lo que hay que tratar de eliminarlas. No obstante, las células depósito que más virus generan son los linfocitos T.
y el virus de la inmunodeficiencia humana (HIV)
(Imagen de Wikipedia).
Hablemos del premio honorífico que le acaban de conceder. ¿Se imaginó en algún momento que le otorgarían el Premio Nobel de Medicina?
Para nada. Ni en sueños.
¿Sabía que era candidata?
No hay candidaturas. Unas personas proponen a otras. Sabía que nuestros nombres figuraban en las listas desde hace años, pero lo sabía de fuentes completamente informales, de boca de mis colegas americanos o extranjeros. Más por parte de los extranjeros que de los franceses. Compañeros que llevaban tiempo luchando para que se otorgara un Premio Nobel en este ámbito.
Yo siempre les decía: «¡No os hagáis ilusiones, nunca concederán un Nobel en este tema!». Lo decía por varios motivos: primero, porque aún no se ha encontrado un tratamiento curativo, y segundo, porque no existe ninguna vacuna efectiva. Por lo tanto, no barajaba la posibilidad de que fueran a concedernos un Premio Nobel.
Además, durante un tiempo hubo una polémica entre los Estados Unidos y Francia que tampoco nos favorecía demasiado. Por eso, no esperaba que fueran a otorgarme el Premio.
¿Cómo reaccionó cuando le dieron la noticia?
No me lo creí. Estaba en Camboya, en una reunión sobre la tuberculosis y el HIV. Me lo comunicó por teléfono una periodista francesa conocida que trabaja en France Inter, junto con mi marido. Le dije: «No es cierto. No sé de dónde has sacado esa información, pero no es verdad». Ella insistió: «Que sí, Françoise, te prometo que es verdad». Se echó a llorar y le colgué. Y justo en ese momento el teléfono empezó a sonar una y otra vez. Y pensé que quizás fuera cierto. Primero pensé en Jean-Claude Chermann y en los pacientes. Pensé sobre todo en ellos y en mi marido.
Los científicos se ven sometidos a presiones cada vez más fuertes: subvenciones para desarrollar proyectos, competitividad, dificultades para publicar los resultados, el sistema de evaluación… ¿Es posible dedicarse a la investigación manteniendo viva la pasión?
Sí, estoy convencida.
¿Es difícil?
Creo que siempre ha sido difícil. Cada época tiene sus propias dificultades, por diversos motivos. No obstante, creo que, por definición, la investigación es una pasión. Yo, al menos, así la considero. Y cuando se tiene una pasión, los obstáculos no existen. Se es capaz de superar todas las dificultades. Claro que la investigación nunca ha sido fácil.
¡Todo un reto!
Cuando se tiene una pasión, creo que nada nos puede detener. Hay que ser perseverante, pase lo que pase. Incluso cuando nos ponen trabas. De sobra es sabido que no es un campo fácil, que las financiaciones son muy limitadas y que sufrimos muchas y diversas barreras de evaluación. Sin perseverancia, sin capacidad de aguante, creo que es mejor no dedicarse a la investigación.
En lo que a las prioridades de los futuros programas científicos se refiere, aparte de las decisiones políticas y de la industria farmacéutica, ¿cree usted que los científicos debieran tener una mayor participación en la definición de estos futuros programas? Creo que la voz de la comunidad científica no tiene demasiada repercusión en este tipo de decisiones.
¿A qué nivel? Porque depende del nivel. En la adopción de decisiones, en la definición de los programas, en las elecciones, en la determinación de las prioridades, en la financiación… Depende del nivel. Los científicos sí que participan en el orden institucional, pero en el nivel ministerial hay una laguna. ¿A qué se debe? Creo que también debemos señalar a los científicos presentes en los ministerios. Ahí están los científicos que se han convertido en puros administrativos, que están a años luz de la evolución de la investigación científica en su conjunto y, por tanto, también de las prioridades científicas. Desgraciadamente, son esas personas las que aconsejan a las autoridades encargadas de tomar las decisiones.
Por eso, abogo por el acercamiento entre políticos y científicos, para al menos consensuar las prioridades.
Siempre que los políticos estén dispuestos a escuchar. Y no siempre se da el caso.
¿Cómo ve usted el mundo científico?
Como una población de seres humanos heterogénea, diversa y apasionada. Como un conjunto de seres humanos, con sus virtudes y defectos. También hay algunos científicos que patinan un poco, y no sólo en el ámbito de la ciencia… El sistema induce un poco a ello. Aunque también contamos con un trasfondo genético que favorece más o menos a la inducción de algunos genes.
Además, nos situamos en un contexto en el que es muy difícil conseguir financiación y en el que algunos científicos proporcionan información con demasiada antelación, sin atender a los resultados reales o proporcionando su propia interpretación, lo que, muchas veces, da falsas esperanzas a los pacientes. Rozan el límite de la deontología y de la ética científica. También hay científicos fascinados con el star system, que también puede ser peligroso. Para mí, el científico forma parte de toda una comunidad. En la gran mayoría de los casos se trata de personas razonables, rigurosas y sensatas. El resto no es más que una minoría, pero está siempre en el candelero.
A su parecer, ¿cuáles son los mayores retos científicos?
En líneas generales, los mayores retos científicos del día de mañana estarán relacionados con el envejecimiento de las poblaciones. Incluso en los países pobres. Porque si la calidad de vida y la salud pública mejoran, aparecerán nuevos problemas en un contexto de recalentamiento del planeta.
A veces, el futuro se presenta confuso.
Sí, a veces. Aunque creo que es la evolución normal del planeta. Siempre ha habido fenómenos de adaptación. Desgraciadamente, este tipo de evoluciones acarrean muchas pérdidas humanas, pero siempre quedan seres vivos que saben adaptarse al nuevo entorno. Por ello, sigo siendo optimista.
Sobre el artículo original
El texto de esta entrevista apareció originalmente en el número 6 de la revista CIC Network, páginas 7-16 (2009).
Se reproduce íntegramente a partir de la edición realizada por César Tomé López en Françoise Barré-Sinoussi entrevistada por Fabienne Aillet (Cuaderno de Cultura Científica, 1 agosto 2013).
Hemos añadido algunos enlaces, para facilitar la lectura, y algunas imágenes.
Sobre la autora
Fabienne Aillet era investigadora en la Unidad de Proteómica de CIC bioGUNE en el momento de la entrevista. Ahora trabaja en la Fundación Inbiomed.